Ein etwas persönlicher Tagungsbericht der EU- PFF25
von Otto Andraschko und Detlev Retar
Das Tagungshotel war, inmitten eines einsamen Waldes mit vielen Wanderwegen, gut gewählt. Der Empfang am Donnerstag war herzlich und professionell. Die Konferenzsprache war Englisch und eine gute Gelegenheit, meines etwas aufzupolieren. Nach der Anreise und dem und Mittagessen ging es in den Tagungsraum, mit Blick durch große Fenster ins Grüne. Begrüßt wurden wir von John Solheim (Präsident, EU PFF) aus Norwegen, selbst ein Betroffener. Prof. Wim Wuyts gab dann einen zeitlichen Überblick über die Entwicklung des Verständnisses von IPF/PF. Dr. med. Gottfried Huss (von Lungenfibrose e.V. und selbst Patient) sprach über die Erwartungen und Pflege der Patienten. Sophie Krick (Boehringer Ingelheim) sagte interessantes über die neuen Entwicklungen der Patientenbeteiligung. Dr. Margaritopoulos sprach über die klinische Versorgung in multidisziplinären Teams und Dr. Thomas Koudstaal über technische und praktische Fortschritte in der Diagnose, Prognose, Überwachung und Selbstmanagement. Prof. Dr. med. Günther eröffnete uns eine Sicht auf die neuesten vorklinischen Forschungen und Studien. Das folgende Panel und der Roundtabel wurden von Liam Galvin (Betroffener aus Irland) und von Steve Jones (Betroffener aus dem U.K.) gekonnt moderiert. Beteiligt waren auch Vanessa Pott (Boehringer), Kati Barett (Trevi) und Meliqui Calzado Vinardelli (Ferrer). John Solheim schloss dann ab und nach diesem sehr intensiven ersten Nachmittag lockten der einsame regnerische Wald und später ein großes Abendessen mit vielen Gesprächen.
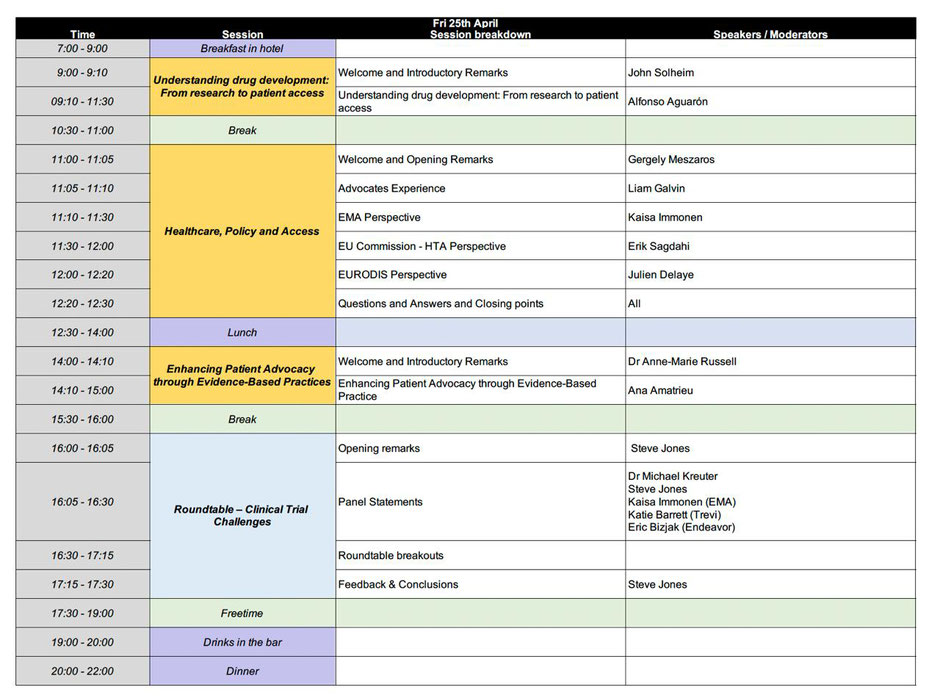
Nach einem Morgenspaziergang im Wald und einem ausgezeichneten Frühstück ging es am Freitag weiter. Alfonso Aguarón, aus einer Betroffenenorganisation, stellte dann in einem mitreißenden Vortrag die Forschung und Entwicklung von Medikamenten vor. Gergely Meszaros brachte detailliert die EU- Sicht ein, Liam Galvin die Sicht der Vertreterorganisationen. Die EMA (Europäische Arzneimittel- Agentur) wurde von Kaisa Immonen gekonnt vorgestellt. Erik Sagdahi stellte HTA (Health Technology Assessment) vor. Die Sicht von EURODIS (Rare Diseases Europe, vertritt Betroffenenorganisationen für seltene Krankheiten wie unsere) wurde von Julien Delaye eingebracht. Dann war es Zeit für einen weiteren Austausch beim Mittagessen, und für einen erfrischenden Waldspaziergang und einen kurzen Schlaf. Dr. Anne-Marie Russell (Cambridge, U.K.) empfing uns dann und leitete den nächsten Vortrag von Ana Amatrieu über die Möglichkeiten der Verbesserung der Patientenvertretungen durch evidenzbasierende Praxis ein. Darauf folgte ein Runder Tisch zu den klinischen Studien und deren Herausforderungen mit Dr. Kreuter, Kaisa Immonen (EMA), Katie Berrett (Trevi) und Eric Bizjak (Endeavor), gekonnt moderiert durch Steve Jones, der dann auch das Feedback einholte. Für mich hieß es dann „ab in den Wald“ um den Kopf etwas zu leeren und nach einer kurzen Rast auf zum Abendessen mit vielen Gesprächen.
Wieder ein erfrischender Morgenspaziergang im diesmal sonnigen Wald am Samstag und ein kräftigendes Frühstück danach. Am Morgen wurden wir von Stefano Pavanello, aus einer norditalienischen Patientenorganisation, herzlich empfangen. Dann sprach wieder Alfonso Aguarón mitreißend über die Rolle der Patienten bei klinischen Studien im Rahmen einer für alle sinnvollen Beteiligung. Nach einer kleinen Pause leitete Radostina Gelova den nächsten interessanten Vortrag über Diversität, Fairness und Inklusion in der Gesundheitspflege und bei der Patientenvertretung von Khullat Munir ein. Schon war es wieder Zeit für mein kräftigendes Mittagsritual. John Solheim empfing uns dann nachmittags zum Thema der effektiven Informations- und Kommunikationstrategien für Patientenorganisationen, gehalten wieder sehr anschaulich von Alfonso Aguarón. Nach einer kurzen Pause rekapitulierte Liam Galvin die beiden Tage und Gergely Meszaros gab einen Überblick über das ERN (European Reference Network) für seltene Atemwegserkrankungen (LUNG). Danach wurden verschiedene EU-PFF Aktivitäten vorgestellt: Stefano Pavanello (IT) schilderte die Arbeitsweise und Entwicklungen (staatliche Anerkennung) in Norditalien, Gottfried Huss erläuterte die Funktionsweise und Entwicklungen seiner deutschen Organisation, Thomas McMillan hielt einen beeindruckenden Vortrag über seine umfangreichen Aktivitäten in Nordirland und Thomas Anderson erzählte von weitreichenden Aktivitäten in Schweden. Fragen und Vorschläge moderierte am Ende wieder John Solheim. Beim Abendessen gab es dann viele Gelegenheiten für Stärkung und Gespräche.
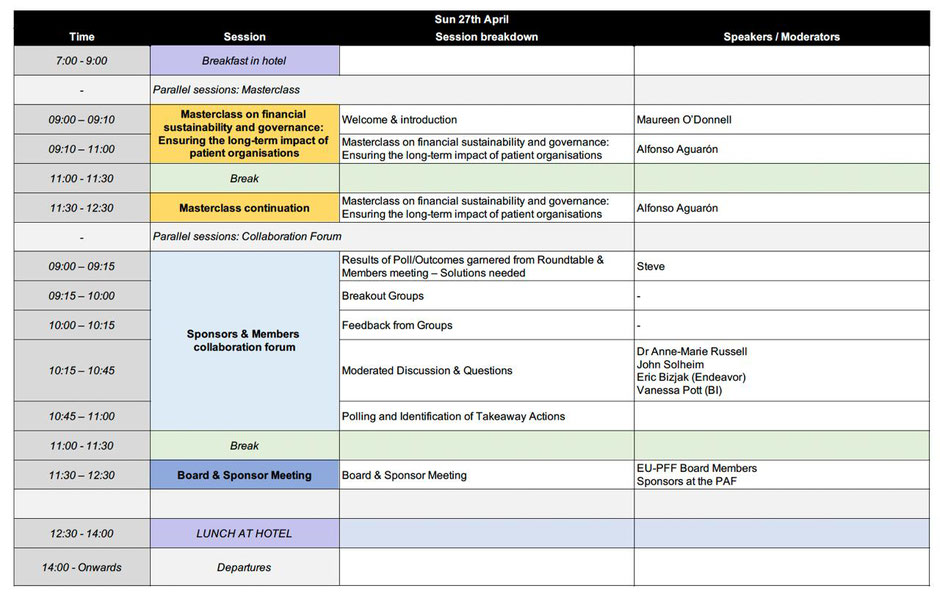
Der nun sonnige Sonntag lud zu einem Morgenspaziergang ein und nach einem kräftigenden Frühstück ging es in die letzte Runde. Empfangen wurden wir in unserer Runde von Maureen O´Donnell (Irland) zum Thema finanzieller Nachhaltigkeit und Leitung von Patientenorganisationen. Genauer nahm sich dieses Thema dann Alfonso Aguarón, in gewohnt mitreißender Art, vor. Er erläuterte an zahlreichen Beispielen die Krisen und das längerfristige Wachsen und Überleben von Patientenorganisationen. Am Ende versammelten wir uns noch einmal alle und es wurden die Teilnahmezertifikate ausgeteilt. Für mich war es nun, nach diesen sehr vielen Eindrücken, Zeit, zu packen, mich zu verabschieden, und abzureisen. Es gab mir viel Hoffnung, dass sich so viele begabte Menschen für eine gute Sache, wie es der Kampf gegen seltene unheilbare Krankheiten ist, europaweit einsetzen.
Otto Andraschko
Lungenfibrose Forum Austria
______________________________________________________________________________________________________________________________________
Es war wieder ein sehr informativer Event, mit zahlreichen Möglichkeiten zum
persönlichen Austausch. Und es war wieder perfekt organisiert. Schwerpunkt lag
diesmal auf “Patient Advocacy”, also um Patienten Rechte und Interessen.
Von besonderem Interesse war gegebenermaßen der aktuelle Stand der Forschung und
ein Update, wann mit neuen Medikamenten zu Behandlung von IPF Patienten zu
rechnen ist. Das von Böhringer Ingelheim entwickelte und vielverssprechende
Nerandomilast hat offensichtlich die finale Phase 3 der Studie erfolgreich absolviert,
und wird in den USA bei der FDA sowie bei der EMA in Europa zu Zulassung eingereicht.
Wie ich aus informierter Quelle in Erfahrung bringen konnte, wird eine FDA Zulassung
noch heuer erwartet. Bei der EMA, die immer mit einiger Zeitverzögerung agiert, ist wohl
mit 2026 zu rechnen. Wie schon gewohnt ist Böhringer sehr restriktiv mit Informationen,
es ist schier unmöglich, nähere Angaben im Internet zu finden. So kann man zwar eine
Homepage darüber finden, sobald man sie aber anklickt, wird man gefragt, ob man ein
Medienvertreter oder eine medizinische Fachkraft außerhalb der USA ist. Wenn man
beides verneint, also die 3. Option anklickt, ist Sense. “PATIENT INVOLVEMENT WITH
INDUSTRY – A WORK IN PROGRESS”, eine der Präsentationen, vorgetragen von Sophia
Krick (Böhringer). Wohl noch sehr “in Progress”.
Das Thema klinische Studien war naturgemäß einer der Schwerpunkte des Events.
Sowohl von Seiten der Pharma Industrie als auch Vertretern der EU PFF wurde kräftig
Werbung für die Teilnahme an solchen Studien gemacht. Es gibt unterschiedliche
Beweggründe für eine Teilnahme, natürlich auch Bedenken, wie zum Beispiel
Befürchtungen, als Versuchskaninchen (engl. Guinea Pig ) missbraucht zu werden.
Für mich persönlich stehen hier Eigeninteressen im Vordergrund, deshalb möchte ich
einen der Vorteile, die vor Ort auch von Pharma Seite bestätigt wurden, anführen: Sollte
eine Studie Erfolg zeigen, man als Teilnehmer aber in der Placebo gelandet ist, kann
man auf den Wirkstoff umsteigen, und kommt so in den Genuss eines früheren Zugangs
zum Medikament.
Ein weiteres Thema stand zum wiederholten Mal zur Diskussion: eine rechtzeitige und
zielgerichtete Diagnose von IPF. Es gibt offensichtlich erhebliche Unterschiede in den
jeweiligen Ländern. Ich persönlich hab da gute Erfahrungen. Vom ersten Verdacht bis
zur endgültigen Diagnose hat es bei mir 3 Monate gedauert, und das auch nur deshalb,
weil kein früherer Termin für eine Bronchoskopie, mit der die genaue Diagnose bestätigt
wurde, verfügbar war. Da der niedergelassene Hausarzt, quasi der erste
Ansprechpartner, aus verständlichen Gründen mit so einer seltenen Erkrankung
überfordert ist, nehme ich jede Gelegenheit, bei der meine Lunge abgehört wird, wahr,
und frage bewusst, ob ein “Knistern” zu hören ist. Ich weiße den Arzt dann darauf hin,
dass das ein starkes Indiz für eine ILD ist. Vielleicht profitieren einige zukünftige
Patienten ja davon.
Ein weiteres Thema: DIVERSITY, EQUITY AND INCLUSION IN
HEALTHCARE AND ADVOCACY. Eine Problematik, der durchaus Beachtung zu
schenken ist. Der Vortrag war nur zu langatmig. Eine halbe Stunde aufzuzählen, warum
Menschen nicht den gleichen Zugang zum Gesundheitswesen haben, war für mich ein
bisschen “boring”, was mir die Kritik von anderen Teilnehmern eingebracht hat. So
what?
Der Obmann der deutschen Schwesterorganisation “Lungenfibrose e.V,” Dr Gottfried
Huss, ein pensionierter Arzt, der auch an IPF leidet und mit dem ich – auch aus
sprachlichen Gründen - mehrmals Kontakt hatte, hat mir ein Exemplar der periodischen
Zeitschrift “Atemwege und Lunge” gegeben. Es ist die Ausgabe 1/2025, mit dem
Schwerpunkt Lungenfibrose. Die verschiedenen Autoren decken viele Bereiche von IPF
ab und sind sicher auch für Patienten unseres “Lungenfibroseforum.at” von Interesse.
Ich werde bei unserem nächsten Jour fixe mal ausloten, wer Interesse hätte. Angeblich
wären die Exemplare kostenlos, aber auch wenn sie was kosten, ist das sicher eine
gute Idee.
Was ich auch interessant fand, es gibt von Seiten der EU PFF auch immer wieder
persönliche Kontakte mit der EU Kommission, quasi Lobbying für unsere Anliegen.
Der Event war wieder eine echte Bereicherung. Man bekommt Informationen über den
neuesten Stand der Forschung, Berichte aus anderen Ländern samt dort gemachten
Erfahrungen.
Detlev Retar
Lungenfibrose Forum Austria
Inhalt
Donnerstag 24. April
Freitag 25. April
Samstag 26. April

Sonntag 27. April
Offizielle Bilder zum download
Glossar (in der Arzneimittelentwicklung verwendeten Schlüsselbegriffe)
Glossar der wichtigsten Begriffe aus der Arzneimittelentwicklung
Forschung und klinische Versuche
Accelerated Access:
Beschleunigter Zugang: Schnellere Zulassungswege für Behandlungen von schweren Erkrankungen mit ungedecktem medizinischer Bedarf, wodurch vielversprechende
Behandlungen schneller verfügbar werden.
Adaptive Trial:
Adaptive Studie: Eine klinische Studie, die so konzipiert ist, dass sie auf der Grundlage von Zwischenergebnissen Änderungen (z. B. Änderung der Dosierung oder Hinzufügen von Teilnehmer) auf der
Grundlage von Zwischenergebnissen.
Blinding:
Verblindung: Den Teilnehmern und/oder Forschern wird nicht mitgeteilt, wer die tatsächliche Behandlung oder das Placebo erhält, um Verzerrungen zu vermeiden.
Compassionate Use: Ermöglichung des Zugangs zu experimentellen Behandlungen für schwerkranke Patienten, die nicht für klinische Studien in Frage kommen, wenn keine anderen
Behandlungen verfügbar sind.
Conditional Aproval: Bedingte Zulassung: Vorläufige Zulassung, die aufgrund erster vielversprechender Ergebnisse erteilt wird und häufig zusätzliche Studien erforderlich sind, um
den Nutzen und die Sicherheit zu bestätigen.
Control Arm: Die Gruppe in einer Studie, die entweder ein Placebo oder eine Standardbehandlung zum Vergleich mit der experimentellen Behandlung.
Crossover: Eine Studie, bei der die Teilnehmer während der Studie von einer Behandlungsgruppe zu einer anderen wechseln,
sodass sie mehrere Behandlungen nacheinander erhalten können.
Endpoint: Endpunkt: Das Hauptergebnis, das gemessen wird, um den Erfolg einer Behandlung zu bestimmen (z. B. Verbesserung der Lungenfunktion Verbesserung oder
Überlebensrate).
Experimental Arm: Versuchsarm: Die Gruppe der Teilnehmer an einer Studie, die die neue oder experimentelle Behandlung erhält, die getestet wird.
HRQoL (Health-Related Quality of Life): Misst, wie sich eine Krankheit oder Behandlung auf das tägliche Leben und Wohlbefinden auswirkt und nicht nur die medizinischen
Ergebnisse.
HTA (Health Technology Assessment): Bewertung der Wirksamkeit, Sicherheit und Kosteneffektivität neuer Behandlungen, um zu entscheiden, ob die Gesundheitssysteme sie
anbieten sollten.
Medicine Market Authorisation (MMA): Marktzulassung für Arzneimittel (MMA): Offizielle Zulassung eines Medikaments, die es erlaubt, es zu vermarkten und in den
Gesundheitssystemen verwendet werden darf.
Off-Label: Verwendung eines zugelassenen Medikaments für Zwecke, die nicht ausdrücklich in der offiziellen Zulassung aufgeführt sind.
p-Wert: Der p-Wert gibt an, wie wahrscheinlich es ist, dass die Ergebnisse einer Studie zufällig zustande gekommen sind und nicht
auf die Behandlung zurückzuführen sind. Je kleiner der p-Wert ist, desto sicherer können wir sein, dass die Behandlung wirklich eine Wirkung hatte - und dass das Ergebnis nicht nur Zufall war.
Normalerweise gilt ein p-Wert von weniger als 0,05 (oder 5 %) als "statistisch signifikant". Das bedeutet, dass die Wahrscheinlichkeit, dass das Ergebnis zufällig ist, weniger als 5 %
beträgt.
PED (Patient Experience Data): Informationen, die direkt von Patienten über ihre Erfahrungen mit einer
Krankheit oder Behandlung, die für die Entwicklung von Arzneimitteln und Entscheidungen im Gesundheitswesen genutzt werden.
Placebo: Eine Scheinbehandlung (wie eine Zuckerpille), die in Studien zum Vergleich und zur Bestätigung der tatsächlichen Wirkung
eines Medikaments genutzt wird.
PROs (Patient-Reported Outcomes): Informationen über gesundheitliche Ergebnisse, die direkt von Patienten berichtet werden
(z. B. Schmerzniveau, Müdigkeit).
Randomisiert: Die Teilnehmer werden nach dem Zufallsprinzip (wie beim Werfen einer Münze) verschiedenen Gruppen zugewiesen, um Verzerrungen zu vermeiden.
Randomisierte kontrollierte Studie (RCT): Eine Studie, bei der die Teilnehmer nach dem Zufallsprinzip einer Behandlungs
oder Kontrollgruppen (oft unter Verwendung eines Placebos) zugeteilt werden, um eine faire Bewertung der Behandlung zu ermöglichen.
Ein-Arm-Studie: Eine Studie, bei der alle Teilnehmer die gleiche Versuchsbehandlung erhalten, ohne Vergleichsgruppe.
Standardbehandlung: Die derzeit allgemein akzeptierte und wirksame Behandlung, die routinemäßig in der medizinischen Praxis verwendet wird.
Research and clinical trials: Forschung und klinische Prüfungen
Phasen klinischer Studien:
* Phase I: "Ist es sicher?"
Teilnehmer: Sehr kleine Gruppe (20-100, in der Regel gesunde Freiwillige).
Ziel: Ermittlung einer sicheren Dosis und Feststellung etwaiger Nebenwirkungen.
Analogie: Wie ein vorsichtiger erster Schluck, um sicherzustellen, dass das Getränk nicht schädlich ist.
* Phase II: "Wirkt es (in der richtigen Dosis)?"
Teilnehmer: Größere Gruppe (einige hundert Patienten mit der Krankheit).
Ziel: Feststellung, ob das Medikament die gewünschte Wirkung hat, und Ermittlung der optimalen Dosis.
Analogie: Prüfen, ob das Getränk tatsächlich den Durst löscht, und die richtige Menge für einen sicheren Genuss bestimmen.
* Phase III: "Ist es besser als das, was wir haben?"
Teilnehmer: Hunderte bis Tausende von Patienten an verschiedenen Standorten.
Ziel: Bestätigung der Wirksamkeit und Überwachung weniger häufiger Nebenwirkungen durch Vergleich mit der derzeitigen
Standardbehandlung oder einem Placebo.
Analogie: Ein direkter Vergleich mit dem derzeit besten Getränk auf einer langen Reise, um festzustellen, ob es wirklich überlegen ist.
* Phase IV: "Langfristige und breitere Anwendung"
Ziel: Verstehen der langfristigen Auswirkungen und der Leistung in der realen Welt.
Analogie: Herausfinden, wie gut die Medizin die Kunden auf breiter Basis und über längere Zeiträume des täglichen
Gebrauchs zufrieden stellt.
Teilnehmer: Breiter öffentlicher Einsatz nach der Zulassung
Bildeindrücke (per Klick vergrößern)
Vielen Dank Otto Andraschko für die Text & Bilddokumentation














Kommentar schreiben